Білки
Білки́ — складні високомолекулярні природні органічні речовини, що складаються замінокислот, сполучених пептидними зв'язками. В однині (білок) термін найчастіше використовують для посилання на білок як речовину, коли неважливий її конкретний склад, та на окремі молекули або типи білків, у множині (білки) — для посилання на певну кількість білків, коли точний склад важливий.
Зазвичай білки є лінійними полімерами — поліпептидами, хоча інколи мають складнішу структуру. Невеликі білкові молекули, тобто олігомери поліпептидів, називаютьсяпептидами. Послідовність амінокислот у конкретному білку визначається відповіднимгеном і зашифрована генетичним кодом. Хоча генетичний код більшості організмів визначає лише 20 «стандартних» амінокислот, їхнє комбінування уможливлює створення великого різноманіття білків із різними властивостями. Крім того, амінокислоти у складі білка часто піддаються посттрансляційним модифікаціям, які можуть виникати і до того, як білок починає виконувати свою функцію, і під час його «роботи» в клітині. Для досягнення певної функції білки можуть діяти спільно, і часто зв'язуються, формуючи великі стабілізовані комплекси (наприклад, фотосинтетичний комплекс).
Функції білків в клітині різноманітніші, ніж функції інших біополімерів — полісахаридів інуклеїнових кислот. Так, білки-ферменти каталізують протікання біохімічних реакцій і грають важливу роль в обміні речовин. Деякі білки виконують структурну або механічну функцію, утворюючи цитоскелет, що є важливим засобом підтримки форми клітин. Також білки грають важливу роль в сигнальних системах клітин, клітинній адгезії, імунній відповіді і клітинному циклі.
Білки — важлива частина харчування тварин і людини, оскільки ці організми не можуть синтезувати повний набір амінокислот і повинні отримувати частину з них із білковою їжею. У процесі травлення протеолітичні ферменти руйнують спожиті білки, розкладаючи їх до рівня амінокислот, які використовуються при біосинтезі білків організму або піддаються подальшому розпаду для отримання енергії.
Білки були вперше описані шведським хіміком Єнсом Якобом Берцеліусом в 1838 році, який і дав їм назву протеїни, від грец.πρώτα — «першорядної важливості». Проте їхня центральна роль в життєдіяльності всіх живих організмів була виявлена лише у1926 році, коли Джеймс Самнер показав, що фермент уреаза також є білком[1]. Секвенування першого білка — інсуліну, тобто визначення його амінокислотної послідовності, принесло Фредерику Сенгеру Нобелівську премію з хімії 1958 року. Перші тривимірніструктури білків гемоглобіну і міоглобіну були отримані за допомогою рентгеноструктурного аналізу, за що автори методу, Макс Перуц і Джон Кендрю, отримали Нобелівську премію з хімії 1962 року[2][3].
Історія дослідження
Білки були виділені в окремий клас біологічних молекул у 18 столітті в результаті робіт французького хіміка Антуана де Фуркруа та інших учених, в яких було відмічено властивість білків коагулювати під час нагрівання або під дією кислот. У той час були досліджені такі білки, як альбумін з яєчних білків, фібрин з крові і глютен із зерна пшениці. Голландський хімік Герріт Мульдер провів аналіз складу білків і виявив, що практично всі білки мають однаковуемпіричну формулу. Мульдер також визначив продукти руйнування білків — амінокислоти — і для однієї з них (лейцину) майже точно визначив молекулярну масу — 131 дальтон.
Мульдеру, зокрема, належить перша модель хімічної будови білків, запропонована ним у 1836році. Виходячи з теорії радикалів, він сформулював поняття про мінімальну структурну одиницю у складі білків. Саме ця одиниця зі складом C16H24N405 отримала пізніше назву «протеїну» (Pr), а концепція — теорії протеїну[4]. Сам термін «протеїн», що в сучасному розумінні означає білок більшістю європейських мов, був запропонований у 1838 році співробітником Мульдера Якобом Берцеліусом[5]. Перевірка цієї моделі привернула увагу відомих хіміків свого часу, таких як Юстус Лібіх і Жан-Батист Дюма. Під впливом нових даних теорія протеїну декілька разів корегувалася, але все ж до кінця 1850-х років від неї довелося повністю відмовитися.
До кінця 19 століття вже було досліджено більшість амінокислот, що входять до складу білків. У 1894 році німецький фізіологАльбрехт Коссель висунув теорію, що амінокислоти є головними структурними елементами білків[6]. На початку 20-го століття німецький хімік Еміль Фішер експериментально довів, що білки збудовані з залишків амінокислот, сполучених пептидними зв'язками. Також він здійснив перші аналізи амінокислотного складу білків та дав пояснення протеолізу. Після 1926 року також стала зрозумілою центральна роль білків в організмах, коли американський хімік Джеймс Самнер (згодом — лауреат Нобелевскої премії) показав, що фермент уреаза також є білком[7].
Вивченню білків перешкоджала складність їхнього виділення. Тому перші дослідження білків проводилися з використанням тих поліпептидів, які могли бути очищені у великій кількості, тобто білків крові, курячих яєць, різних токсинів і травних/метаболічнихферментів, які можна було виділити в місцях забою худоби. Наприкінці 1950-х років компанія Armour Hot Dog Co. змогла очистити кілограм бичачої панкреатичної рибонуклеази А, яка стала експериментальним об'єктом для багатьох учених.
Ідея про те, що вторинна структура білків утворюється в результаті формування водневих зв'язків між амінокислотами, була висловлена Вільямом Астбері в 1933 році, але Лайнус Полінг вважається першим ученим, який зміг успішно передбачити вторинну структуру білків. Пізніше Волтер Каузман, спираючись на роботи Кая Ліндерстрем-Ланга, зробив вагомий внесок до розуміння законів утворення третинної структури білків і ролі в цьому процесі гідрофобних взаємодій. У 1949 році Фред Сенгер визначив амінокислотну послідовність інсуліну, продемонструвавши таким способом, що білки — це лінійні полімери амінокислот, а не розгалужені (як у деяких цукрів) ланцюжки, колоїди або циклоли.
Перші структури білків, що ґрунтуються на методах рентгеноструктурного аналізу на рівні окремих атомів, були отримані в 1960-х роках, а за допомогою ЯМР-спектроскопії — в 1980-х роках. У 2006 році Банк даних білків (Protein Data Bank) містив приблизно 40 000 структур білків. У наш час[Коли?] кріоелектронна мікроскопія великих білкових комплексів за роздільною здатністю наближається до атомного рівня.
Особливістю досліджень білків початку 21-го століття є одночасне отримання даних про білковий склад цілих клітин, тканин абоорганізмів — протеоміка. У результаті необхідності аналізу цих даних та росту можливостей обчислювальних технологій активно розвиваються методи біоінформатики аналізу та порівняння білкових структур та обчислювальні методи передбачення структури білків, наприклад, методи молекулярної динаміки, призначені замінити в майбутньому експериментальне визначення білкових структур.
Будова[ред. • ред. код]
Склад[ред. • ред. код]
Молекули білків є лінійними полімерами, що складаються з α-L-амінокислот (які є мономерами цих полімерів) і, в деяких випадках, з модифікованих основних амінокислот (щоправда модифікаціївідбуваються вже після синтезу білка на рибосомі). Для позначення амінокислот в науковій літературі використовуються одно- або трьохбуквені скорочення. Хоча на перший погляд може здатися, що використання «всього» 20 основних типів амінокислот обмежує різноманітність білкових структур, насправді кількість варіантів важко переоцінити: для ланцюжка всього з 5 амінокислот воно становить вже більше 3 мільйонів, а ланцюжок з 100 амінокислот (невеликий білок) може бути представлений більш ніж у 10130варіантах (для порівняння — кількість атомів у Всесвіті оцінюється приблизно у 1080). Поліпептидні ланцюжки завдовжки від двох до кількох десятків амінокислотних залишків зазвичай називають пептидами, а довші — власне білками або протеїнами, хоча цей поділ вельми умовний.
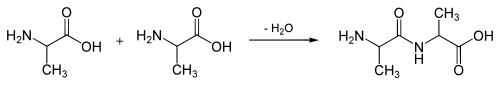
При утворенні білка в результаті взаємодії α-аміногрупи (-NH2) однієї амінокислоти з α-карбоксильною групою (-СООН) іншої амінокислоти утворюються пептидні зв'язки. Кінці білка називають С- і N- кінцями (залежно від того, яка з груп кінцевої амінокислоти вільна: -COOH чи -NH2, відповідно). При природному синтезі білка на рибосомі нові амінокислоти приєднуються до C-кінця, тому назва пептиду або білка дається шляхом перерахування амінокислотних залишків починаючи з N-кінця.
Послідовність амінокислот у білку відповідає інформації, що міститься в гені даного білка. Ця інформація представлена у виглядінуклеотидної послідовності, причому одній амінокислоті відповідає одна або декілька послідовностей з трьох нуклеотидів — так званих кодонів. Те, яка амінокислота відповідає даному кодону в ДНК та мРНК (проміжній ланці біосинтезу білків), визначаєтьсягенетичним кодом, який може дещо відрізнятися у різних організмів.
Гомологічні білки (що виконують одну функцію і мають загальне еволюційне походження, наприклад, гемоглобіни) різних організмів мають в багатьох місцях ланцюжка різні амінокислотні залишки, які називають варіабельними, на противагу консервативним, спільним залишкам. За ступенем гомології можна оцінити еволюційну відстань між різними таксонами організмів.
Рівні структури
Окрім послідовності амінокислот поліпептиду (первинної структури), для функціонування білків украй важлива тривимірна структура, яка формується в процесі згортання білків (або фолдинга, від англ. folding). Ця структура утримується в результаті взаємодії структур нижчих рівнів. Тривимірна структура білків за нормальних природних умов називається нативним станом білка. Хоча чимало білків здатні згортатися та приймати нативний стан самостійно, завдяки властивостям свого поліпептидного ланцюжка, інші вимагають допомоги інших білків, молекулярних шаперонів. Виділяють чотири рівні структури білків[8]:
- Первинна структура — пептидна або амінокислотна послідовність, тобто послідовність амінокислотних залишків у пептидному ланцюжку. Саме первинна структура кодується відповідним геном і найбільшою мірою визначає властивості сформованого білка.
- Вторинна структура — локальне впорядковування фрагменту поліпептидного ланцюжка, стабілізоване водневими зв'язками і гідрофобними взаємодіями. Найпоширеніші типи вторинної структури білків включають[9]: α-спіралі (спіраль, що має 4 залишки на виток, стабілізована водневими зв'язками між пептидними групами з кроком у 4 ланки) і β-листи (кілька зигзагоподібних поліпептидних низок, в яких водневі зв'язки утворюються між відносно віддаленими ділянками ланцюжка або між різними ланцюжками, а не між близько розташованими пептидними групами, як це має місце для α-спіралі). Інші елементи вторинної структури включають π-спіралі (спіралі з кроком водневих зв'язків у 3 ланки), -спіралі (спіралі з кроком водневих зв'язків у 5 ланок), повороти, невпорядковані фрагменти та інші. Найпоширеніша єдина класифікація таких структур — номенклатура DSSP.
- Третинна структура — повна просторова будова цілої білкової молекули, просторове взаємовідношення вторинних структур одна до одної. Третинна структура загалом стабілізується нелокальними взаємодіями, найчастіше формуваннямгідрофобного ядра, а також завдяки утворенню водневих зв'язків, солевих містків, інших типів іонних взаємодій,дисульфідних зв'язків між залишками цистеїну.
- До третинної структури зазвичай відносять і проміжні рівні між основними елементами вторинної структури та повною структурою білка — «надвторинну» структуру, що складається ізструктурних мотивів та доменів. Структурні мотиви — невеликі усталені поєднання кількох елементів вторинної структури, що мають схожу структуру, важливу для виконання білком певних функцій. Схожі структурні мотиви зазвичай виконують схожі функції, завдяки чому за ними можна передбачити функцію невідомого білка. Хоча структурні мотиви можуть бутианалогічними, частіше за все вони зберігаються в процесіеволюції видів. Домени — дещо більші елементи структури білка, що характеризуються стабілізацією незалежною від решти поліпептидного ланцюжка, і що часто виконують окрему функцію. В процесі еволюції елементи надвторинної структури можуть передаватися між генами, надаючи їм нові функції, таким чином існує набагато менше різновидів цих елементів, ніж різних білків. Процес передачі доменів можна здійснити і штучними методамигенної інженерії, створюючи химерні білки.
- Четвертинна структура — структура, що виникає в результаті взаємодії кількох білкових молекул, які в даному контексті називають субодиницями. Повна структура кількох поєднаних субодиниць, що разом виконують спільну функцію, називаєтьсябілковим комплексом.
Розміри
Розмір білка може вимірюватися за числом амінокислот або в одиницях молекулярної маси — дальтонах — Да (частіше, у зв'язку із великими розмірами молекул, в похідних одиницях — кілодальтонах — кДа). Найбільшим відомим одиничним білком єтітін (компонент саркомер м'язів), що містить понад 29 тис. амінокислот і має молекулярну масу 3 МДа[10], а найбільший внутрішньоклітинний білковий комплекс — комплекс ядерної порихребетних тварин — має масу близько 125 МДа[11]. Проте загалом важко говорити про найбільший розмір білкового комплексу, тому що часто комплекси мають дуже обмежений час життя, крім того, весь цитоскелет клітини, або позаклітинна матриця цілого організму може вважатися єдиним комплексом. Найменший білок також важко визначити, багато білків, що мають ензиматичну активність, не перевищують за розміром кілька десятків амінокислот, багато пептидних гормонів мають ще менші розміри. Інколи найменшим білком вважають єдину невелику амінокислоту пролін, що має самостійну каталітичну активність[12].
Хімічні властивості
Білки також характеризуються ізоелектричною точкою (pI) — кислотністю середовища pH, при якому молекула даного білка не несеелектричного заряду. Чим більше в даному білку гідроксильних груп (основних залишків), тим вище у нього pI. Білки з pI, меншим за 7, називаються кислотними, а з більшим за 7 — основними. В цілому pI білка залежить від функції, яку він виконує; так, білки, що зв'язуються з нуклеїновими кислотами, часто належать до основних. Прикладом таких білків є гістони.
За ступенем розчинності у воді білки бувають розчинними (гідрофільними) і нерозчинними (гідрофобними). До останніх відносяться більшість білків, що входять до складу біологічних мембран, тобто інтегральних мембранних білків, які взаємодіють з гідрофобнимиліпідами мембрани[13].
Прості і складні білки
За складом виділяють прості і складні білки. Прості білки містять тільки амінокислоти, зв'язані в ланцюжки. На відміну від них складні білки мають також неамінокислотні групи. Ці додаткові групи у складі складних білків називаються простетичними групами. Деякі простетичні групи служать кофакторами, необхідними для роботи ферментів. Інші, такі як полісахаридні ланцюжки, допомагають білку приймати потрібну конформацію і додають додаткову стабільність. Прикладами органічних простетичних груп в складі білків служать гем (в складі гемоглобіну), тіамін, біотин та інші. Неорганічні простетичні групи найчастіше складаються з іонівметалів, найпоширенішими з яких є цинк, магній і молібден[14]. За типом простетичної групи складні білки поділяють наглікопротеїни, ліпопротеїни, хромопротеїни, нуклеопротеїни, фосфопротеїни, металопротеїни та деякі інші.
Денатурація білків[ред. • ред. код]
Як правило, білки протягом досить довгого часу зберігають структуру і, отже, фізико-хімічні властивості, наприклад, розчинність, в умовах (таких як pH, температура), до яких пристосований даний організм або які підтримуються в його межах в результаті збереженнягомеостазу[7]. Різка зміна цих умов, наприклад, внаслідок нагрівання або обробки білка кислотою чи лугом, приводить до втрати четвертинної, третинної і вторинної структур білка, цей процес називається денатурацією. Відомий випадок денатурації білка в побуті — приготування курячого яйця, коли під впливом високої температури розчинний у воді прозорий білоковальбумін стає щільним, нерозчинним і непрозорим.
Білки, що використовуються в технологічних методах і вимагають нетипових умов, часто підбираються з екстремофілів — організмів, здатних проживати в екстремальних умовах. Так, наприклад, ДНК-полімераза Taq, що використовується в полімеразній ланцюговій реакції(ПЛР), може витримувати без денатурації багаторазове нагрівання до 95 °C. Вона була спочатку виділена з бактерії Thermus aquaticus. Денатурація в деяких випадках оборотна, як, наприклад, при преципітації водорозчинних білків за допомогою солей амонію, і використовується як спосіб їхнього очищення[15].
Біосинтез та життєвий цикл білків
Рибосомний синтез
Живі організми синтезують білки з амінокислот на основі інформації, закодованої в генах. Кожен білок складається з унікальної послідовності амінокислот, яка визначається нуклеотидною послідовністю гену, що кодує даний білок. Генетичний код складається з трибуквених «слів», які називаються кодонами. Кожен кодон відповідає за приєднання до білка однієї амінокислоти: наприклад, поєднання AUG (АУГ) відповідає метіоніну. Оскільки ДНК складається з чотирьох типів нуклеотидів, то загальне число можливих кодонів дорівнює 64; а оскільки в білках використовується 20 амінокислот, то багато амінокислот визначаються більш ніж одним кодоном. Гени, що кодують білки, спочатку транскрибуются в послідовність нуклеотидів матричної РНК (мРНК) білками РНК-полімеразами.
У прокаріотів мРНК може зчитуватися рибосомами в амінокислотну послідовність білків відразу після транскрипції, проте в більшості випадків у еукаріотів та інколи у бактерій вона оброблюється в процесі сплайсингу. Після цього еукаріоти повинні такожтранспортувати зрілу мРНК з ядра в цитоплазму, де знаходяться рибосоми.
Швидкість синтезу білків вища у прокаріотів і може досягати 20 амінокислот в секунду[16].
Процес синтезу білка з мРНК називається трансляцією. Під час початкової стадії трансляції — ініціації, кодон метионіну розпізнається малою субодиницею рибосоми, до якої за допомогою білкових факторів ініціації приєднана метионінова транспортна РНК (тРНК). Після розпізнавання стартового кодону до малої субодиниці приєднується велика субодиниця рибосоми, і починається друга стадія трансляції — елонгація. На кожному кроці рибосоми від 5'- до 3'-кінця мРНК прочитується один кодон шляхом утворення водневих зв'язків між трьома нуклеотидами (кодоном) мрРНК і комплементарним йому антикодоном транспортної РНК, до якої приєднана відповідна амінокислота. Синтез пептидного зв'язку каталізує рибосомна РНК (рРНК), що утворює пептиділтрансферазний центр рибосоми. Рибосомна РНК каталізує утворення пептидного зв'язку між останньою амінокислотою пептиду і амінокислотою, приєднаною до тРНК, позиціонуючи атоми азоту і вуглецю в положенні, сприятливому для проходження реакції. Фермент аміноацил-тРНК-синтетаза приєднує амінокислоти до їхньої тРНК. Третя і остання стадія трансляції, термінація, відбувається при досягненні рибосомою стоп-кодону, який не кодує амінокислот, після чого білкові фактори термінації гідролізуютьостанню тРНК від білка, припиняючи синтез. В рибосомах білки завжди синтезуються від N- до C-кінця.
Нерибосомний синтез[ред. • ред. код]
У деяких грибів і деяких бактерій існує менш поширений спосіб біосинтезу білків, який не вимагає участі рибосом. Синтез пептидів, зазвичай вторинних метаболітів (так званих нерибосомних пептидів), проводиться високомолекулярним білковим комплексом, NRP-синтетазою (від англ. nonribosomal peptide synthetase — «нерибосомна синтетаза пептидів»). NRP-синтетаза зазвичай складається з декількох доменів або окремих білків, що здійснюють підбір амінокислот, утворення пептидного зв'язку, вивільнення синтезованого пептиду й іноді має домен, здатний ізомерізувати L-амінокислоти (нормальна форма) в D-форму[17][18].
Посттрансляційні модифікації білків
Після завершення трансляції і вивільнення білка з рибосоми амінокислоти у складі поліпептидного ланцюжка піддаються різноманітним хімічним модифікаціям. Ці модифікації здатні значно розширити різноманітність можливих білків, надаючи їм нові властивості. Прикладами посттрансляційних модифікацій служать:
- приєднання різних функціональних груп (ацетил-, метил- і фосфатних груп);
- приєднання ліпідів і вуглеводнів;
- зміна стандартних амінокислот на нестандартні (наприклад, утворення цитруліну);
- утворення структурних змін (утворення дисульфідних містків між цистеїнами);
- видалення частини білка як на початку (сигнальна послідовність або метіонін, що кодується старт-кодоном), так і в окремих випадках в середині (інсулін);
- додавання невеликих білків, які впливають на деградацію білків (сумоїлювання і убіквітинювання).
При цьому тип модифікації може бути як універсальним — додавання ланцюжків, що складаються з мономерів убіквітину, служить сигналом для деградації цього білка протеасомою — так і специфічним для даного білка[19]. Водночас один і той же білок може піддаватися численним модифікаціям. Так, гістони, білки, що входять до складу хроматину еукаріотів та архей, за різних умов можуть зазнавати до 150 типів різних модифікацій[20].
Сортування білків
Багато білків, які синтезує клітина, призначені для використання у відповідних органелах, на мембранах клітини або у міжклітинному просторі, якого білки досягають шляхом секреції. Правильне сортування критичне для клітини, помилки у цьому процесі часто призводять до хвороб. Процес сортування і транслокації білків здійснюється, виходячи з інформації, що міститься безпосередньо в самому білку. Ця інформація, так звані сигнали сортування, може міститися як в пептидній послідовності білка, так і в просторовій структурі згорнутого білка.
Найпоширенішим механізмом сортування є розпізнавання N-термінальної сигнальної послідовності білка під час синтезу. В цьому випадку комплекс рибосоми з білком переміщається до поверхні шорсткого ендоплазматичного ретикулума (ЕПР). Там поліпептид, що синтезується, розпізнається транслокаційним комплексом і проходить через мембрану ЕПР. У випадку білків, призначених до секреції, сигнальна послідовність під час синтезу відщеплюється від поліпепдиду сигнальною пептидазою. Для деякихтрансмембранних білків ця обробка дещо відрізняється.
Деякі білки транслюються цілком в цитозолі, після чого прямують до місця призначення. Це відбувається для білків, призначених для мітохондрій, хлоропластів або пероксисом (в останньому випадку білки зазвичай мають сигнальну послідовність на C-кінці). Також посттрансляційно переміщаються білки, призначені для ядра клітини, вони перетинають ядерну оболонку через ядерні пори.
У бактерій основний механізм сортування білків цитоплазматичної мембрани подібний до еукаріотичного, проте для інших відділів клітини бактерії містять системи секреції I типу, II типу, III типу тощо.
Згортання білків і підтримка їхньої структури
Здатність білків відновлювати правильну тривимірну структуру після денатурації дозволила висунути гіпотезу про те, що вся інформація про кінцеву структуру білка міститься в його амінокислотній послідовності. В наш час[Коли?] загальновизнана теорія про те, що стабільна форма білка має мінімальну вільну енергію в порівнянні з іншими можливими формами цього поліпептиду[21].
Проте кінцева структура буває дуже складною, а процес її прийняття новосинтезованим поліпептидним ланцюжком вимагає деякого часу. Процес прийняття білком цієї структури називається згортанням або фолдингом (від англ. folding). Невеликі однодоменні білки розміром до 100 амінокислот зазвичай згортаються за один крок, таке згортання займає кілька мілісекунд і зазвичай відбувається одночасно з трансляцією[22][23]. З іншого боку, великі складні білки вимагають кілька хвилин або годин для фолдингу, перш за все через ізомеризацію проліну та формування помилкових дисульфідних містків. Такі білки повинні пройти через ряд проміжних кроків для завершення процесу[24].
Багато білків не здатні завершити згортання самостійно і досягти нативного стану, часто через взаємодію з іншими білками клітини. Такі білки вимагають зовнішньої допомоги від білків спеціального класу — молекулярних шаперонів. Часто шаперони необхідні лише за певних умов, наприклад за умов теплового шоку, коли висока температура призводить до збільшення числа помилок згортання[25].
Важливість нормальної роботи шаперонів для функціонування організму може бути проілюстрована на прикладі шаперону α-кристаліну, що входить до складу кришталика ока людини. Мутації в цьому білку призводять до помутніння кришталика черезагрегування білків і, як наслідок, до втрати кришталиком ока прозорості й до катаракти[26].
Функції білків в організмі
Класифікація білків за функцією може бути як біохімічною, тобто за типом безпосередньої біохімічної функції, яку білок виконує в організмі, так і заснованою на головних клітинних процесах, один з кроків яких виконує даний білок. В останньому випадку класифікація включає такі категорії[27]:
- Обробка та збереження інформації (процеси реплікації, експресії генів та підтримки геному);
- Клітинні процеси та сигнали (контроль клітинного циклу, підтримка структури клітини та органів, транспорт, модифікації макромолекул, сигнальні системи);
- Метаболізм (отримання та перетворення енергії, синтез та транспорт ліпідів, амінокислот, цукрів, неорганічних молекул,вторинних метаболітів).
У кожному організмі є невелика кількість білків, які виконують дві чи більше операцій. Найчастіше ці операції належать до одного функціонального блоку. Наприклад, лізил-тРНК-синтетаза ссавців є інформаційним білком, що приєднує лізин до тРНК і також регулює реплікацію ДНК і транскрипцію кількох генів[28]. Білок CtrA бактерії Caulobacter crescentus контролює клітинний цикл через регуляцію реплікації і транскрипції[29]. Аналіз геномів показав, що у різних організмів існує велика різниця у кількості білків, що виконують ту чи іншу функцію. Особливо це стосується операційних білків від яких залежить адаптація організму до його екологічної ніші. Цікаво, що у людини та деяких інших організмів частина білків не повністю закодована в успадкованому геномі. Так, велика різноманітність імуноглобулінів досягається за рахунок рекомбінації та мутацій відповідних генів, що тривають протягом усього життя в клітинах імунної системи. Також не треба забувати, що виявлення функцій білків ще не закінчилося: у будь якому організмі 20% чи більше білків виконують функції, про які ще нічого не відомо.
Особливості білків порівняно з іншими біомолекулами[ред. • ред. код]
Білки — головні гравці у процесах в межах клітини. Вони виконують специфічні завдання залежно від інформації, закодованої у відповідних генах[30]. За винятком певних типів РНК більшість біомолекул часто розглядаються як інертні субстрати, на які діють білки. Білки складають половину сухої ваги клітин Escherichia coli(Кишкової палички), тоді як такі молекули як ДНК і РНК — лише 3% і 20%, відповідно[31]. Повний набір білків специфічної клітини або типу клітин називаєтьсяпротеомом.
Головна характеристика білків, що дозволяє їм виконувати різноманітний набір функцій — здатність специфічно та щільно зв'язуватися з іншими молекулами. Ділянки білків, що відповідають за таке зв'язування, називаються ділянками зв'язування. Вони часто мають вигляд вигину або «кишені» на поверхні молекули. Ця здатність до зв'язування опосередкована третинною структурою білка, яка визначає розташування кишень зв'язування, і хімічними властивостями амінокислот навколишніх бічних ланцюгів. Зв'язування білків може бути надзвичайно щільним та специфічним, наприклад, білок-інгібітор рибонуклеази зв'язується з людським ангіогеніном з менш ніж фемтомолярною константою дисоціації (<10−15 М), але взагалі не зв'язується з його гомологом, онконазою, отриманою з клітин жаб (>1 М). Надзвичайно незначної хімічної зміни, такої як додавання до партнера зв'язування єдиної метильної групи, іноді може бути достатньо для того, щоб майже виключити зв'язування; наприклад, аміноацил-тРНК-синтетаза специфічна до амінокислоти валіну чітко відрізняє його від дуже подібного бічного ланцюгаізолейцину.
Білки можуть зв'язуватися з іншими білками, іншими біомолекулами та невеликими субстратами. Коли білки зв'язуються з іншими копіями тієї ж самої молекули, вони утворюють олігомери, які у деяких випадках формують волокнину; цей процес часто відбувається в структурних білках, які складаються з кулястих мономерів, що є партнерами у взаємному зв'язуванні. Він дозволяє формувати міцні волокна. Білок-білкова взаємодія також регулює ферментативну діяльність, управляючи протіканням клітинного циклу, і надає клітині змогу утворювати великі білкові комплекси, які здійснюють багато складних реакцій, важливих для виконання основних біологічних функцій. Крім того, партнери зв'язування часто здатні індукувати конформаційні зміни в білках, що дозволяє утворення надзвичайно складних сигнальних мереж.
Каталітична функція[ред. • ред. код]
Найкраще відома роль білків в організмі — каталіз різних хімічних реакцій. Ферменти — тип білків, що характеризується специфічними каталітичними властивостями, тобто кожний фермент каталізує одну або декілька реакцій. Ферменти каталізують реакції розщеплювання (катаболізм) і синтезу (анаболізм) складних молекул, зокрема, синтез та деградацію ДНК, РНК, білків, ліпідів та цукрів. Крім того вони каталізують синтез та деградацію малих молекул, хімічні модифікації та ряд інших реакцій, необхідних для життєдіяльності. Відомо близько 4 тис. реакцій, що каталізуються ферментами, багато з них протікають поза межами клітин[32], наприклад фермент пепсинрозщеплює білки в процесі травлення. Прискорення реакції в результаті ферментативного каталізу часто величезне: наприклад, реакція, що каталізується ферментом оротат-карбоксилазою протікає в 1017 разів швидше[33], ніж без каталізатора (без ферменту реакція відбувалася б раз у 78 мільйонів років, а за участю ферменту відбувається раз у 18 мілісекунд). Молекули, які змінюються в результаті реакції при посередництві ферментів, називаються субстратами.
Хоча ферменти зазвичай складаються з сотень амінокислот, тільки невелика частина з них взаємодіє з субстратом, і ще менша кількість — в середньому 3-4 амінокислоти в одній молекулі білка, часто розташовані далеко одна від іншої в первинній амінокислотній послідовності, — безпосередньо беруть участь в каталізі[34]. Частина ферменту, яка з'єднується із субстратом і містить каталітичні амінокислоти, називається активним центром ферменту.
Структурна функція[ред. • ред. код]
Структурні білки часто грають роль арматури, що надає форму та жорсткість клітинам та тканинам. Зазвичай ці білки здатні формувати довгі філаменти або зв'язувати філаменти, сформовані іншими білками — частина структурних білків є фібрилярними, інші формують філаменти за допомогою полімеризації глобул білка за певних умов[35]. Структурну роль всередині клітини грають компоненти цитоскелету: наприклад глобулярні актин і тубулін в еукаріотів та їхні бактеріальні гомологи FtsZ та MreB. Ці білки дуже динамічні, тобто можуть полімеризуватися при потребі. Вони відіграють роль не тільки у забезпеченні структури, але й у локомоції клітин та клітинному поділі. Інші компоненти цитоскелету — проміжні філаменти еукаріотів та бактеріальний кресцентин — фібрилярні й мають перш за все структурну функцію. Важлива також структурна роль компонентів міжклітинної матриці. Деякі з них збираються в значних кількостях і відіграють роль у забезпеченні структури окремих органів, наприклад, міжклітинний кератин важливий для підтримки структури волосся, нігтів і пір'я птахів. Колаген, ламінін і еластин важливі для підтримки епітелію стінок порожнин організму — легенів, шлунка тощо. Крім того, колаген і еластин — основні компоненти сполучної тканини (наприклад, хряща). Структурні білки також складають клітинну стінку багатьох архей і відіграють роль в утриманні разом полісахаридних компонентів клітинних стінок рослин та бактерій.
Захисна функція[ред. • ред. код]
Багато білків, що входять до складу крові, беруть участь в захисній відповіді організму як на пошкодження, так і на атаку патогенів. Прикладами першої групи білків служать фібриногени ітромбіни[36], що беруть участь в згортанні крові, а антитіла (імуноглобуліни), нейтралізують бактерії,віруси або чужорідні білки. Анти









Немає коментарів:
Дописати коментар